الوحدة الأولى: تطور كمية المادة للمتفاعلات والنواتج
المؤكسد – المرجع – تفاعل أكسدة إرجاع.
- المؤكسد: هو كل فرد كيميائي قادر على اكتساب الكترونات.
- المرجع: هو كل فرد كيميائي قادر على فقدان الكترونات.
- تفاعل أكسدة وإرجاع: هو تفاعل يحدث فيه انتقال الإلكترونات من المرجع إلى المؤكسد.
- يكون المزيج الستيوكومتري إذ اختفت المتفاعلات كليا ونقول أن الشروط الستيوكومترية محققة : `n_(0A)/a=n_(0B)/b`
- التفاعل بطيء: يستغرق مدة زمنية طويلة (دقائق أو ساعات).
- تام: يوجد متفاعل محد واحد على الأقل.
- نعني بمتابعة تحول كيميائي: معرفة تقدم التفاعل في كل لحظة.
- يمكن متابعة تحول كيميائي في الحالتين: أ- متابعة بقياس الحجم والضغط. ب- متابعة بقياس الناقلية.
- نلجأ إلى المتابعة بقياس الضغط أو الحجم إذا استهلك أو نتج غاز.
- ب. نلجأ إلى المتابعة بقياس الناقلية إذا استهلكت أو نتجت شوارد.
- خواص تفاعل المعايرة: سريع وتام.
- في المتابعة بطريقة المعايرة نبرد العينات مباشرة بعد فصلها لإيقاف تشكل ناتج أو اختفاء متفاعل قصد تحديد كمية المادة لحظة أخذ العينة.
- نكشف تجريبيا عن حدوث التكافؤ عندما يحدث التغير اللوني للمحلول المعاير في البيشر.
- زمن التفاعل `t_ (1/2)` وكيف يحدد بيانيا وما أهمية معرفته؟ زمن التفاعل الزمن `t_(1/2)`هو: الزمن اللازم لبلوغ التفاعل نصف تقدمه الأعظمي إذا كان تاما أو نصف تقدمه النهائي إذا كان غير تام.
- أهميته: يسمح بتقدير المدة اللازمة لانتهاء التحول الكيميائي المدروس والذي يوافق غالبا عددا محدودا بين `4t_(1/2)` و `7t_(1/2)`
السرعة اللحظية للتفاعل والسرعة الحجمية للتفاعل.
- السرعة اللحظية للتفاعل: هي مشتق التقدم بالنسبة للزمن: `v=dx/dt`
- السرعة الحجمية للتفاعل: هي النسبة بين السرعة اللحظية للتفاعل وحجم الوسط التفاعلي: `v_V=v/V`
الوسيط وأنواع الوساطة:
- الوسيط: نوع كيميائي يسرع التفاعل ولا يشارك فيه.
أنواع الوساطة:
- 1. وساطة متجانسة: إذا كان الوسيط من نفس الحالة الفيزيائية للمتفاعلات.
- 2. وساطة غير متجانسة: إذا كانت الحالة الفيزيائية للوسيط تختلف عن الحالة الفيزيائية ألحد المتفاعلات.
- 3. وساطة إنزيمة : إذا كان الوسيط عبارة عن إنزيم.
تأثَير العوامل الحركية على سرعة التفاعل على المستوى المجهري:
- الرفع من درجة حرارة التفاعل أو استعمال وسيط أو زيادة التراكيز الابتدائية يؤدي إلى زيادة عدد التصادمات الفعالة وبالتالي زيادة سرعة التفاعل.
كيف تتطور السرعة في أي تفاعل ولماذا؟
- تتناقص السرعة بمرور الزمن بسبب تناقص التراكيز الابتدائية للمتفاعلات.
الوحدة الثانية: دراسة التحولات النووية
- النواة المشعة: هي نواة غير مستقرة تتفكك بتحول تلقائي مصدرة إشعاعات.
- النظائر: هي مجموعة من الذرات لها نفس العدد الذري وتختلف في العدد الكتلي.
- التحول `β^-`: هو انبعاث الكترون بسبب تحول النيترون إلى بروتون في النواة.
- التحول `+^β` : هو انبعاث بوزيترون بسبب تحول البروتون إلى نيترون في النواة.
- التحول α: هو انبعاث نواة هليوم بسبب تخلي النواة الأم عن بروتونين ونيترونين.
- التحول γ : هو انبعاث أشعة كهرومغناطيسية ترافق الإشعاعات السابقة إذا كانت النواة الابن في حالة مثارة.
- المنحنى Z-N : يمثل علاقة بيانية بين عدد النيترونات N وعدد البروتونات Z في الأنوية المعروفة. ويفيدنا في تحديد مواقع الأنوية المستقرة بالنسبة للمستقيم Z = N وذلك حسب قيم Z.
- النشاط الإشعاعي: هو عدد التفككات في وحدة الزمن.
- جهاز قياس النشاط الإشعاعي: عداد جيجر مولر.
- وحدة قياسه: هي البكريل Bq( تفكك واحد في الثانية) و (`S^-1`) في (SI)
- قانون التناقص الإشعاعي: ` N(t)=N_0e^(-lambda t)`
- قانون النشاط اإلشعاعي: `A(t)=A_0e^(-Lambda t)`
- زمن نصف العمر `t_(1/2)`:هو الزمن اللازم لتفكك نصف العدد االبتدائي من األنوية المشعة.
- بيانيا: `N(t_(1/2)) =N_0/2`
- اليورانيوم 238 موجود حتى الآن على الأرض لأنه يتميز بنصف عمر كبير (من رتبة `10^9 years` ).
- التفكك النووي والتفاعل النووي : التفكك النووي طبيعي تلقائي أما التفاعل النووي اصطناعي مفتعل ويحدث بمؤثر خارجي.
- طاقة الربط `E_l` : هي طاقة تماسك النواة:$ E_1=[(Zm_p+(A-Z)m_n)-m(\sideset{ _Z^AX } ])\times C^2 $
- تفاعل الانشطار: هو تفاعل مفتعل يتم فيه قذف نواة ثقيلة وقليلة الاستقرار بجسيمات مثل النيترونات للحصول على نواتين أقل ثقال وأكثر استقرارا.
- تستخدم النيترونات في قذف أنوية اليورانيوم لأنها متعادلة كهربائيا.
- انشطار النواة الأولى لليورانيوم يعطي نيترونات تؤدي بدورها لانشطار أنوية جديدة وهكذا يتسلسل تفاعل الانشطار.
- الطاقة المحررة : ` E_(lib)=Deltam \times C^2 `، `Delta m = m_f-m_i`
- تظهر الطاقة المحررة على شكل حرارة كبيرة وطاقة حركية كبيرة لمختلف الجسيمات وإشعاعات.
- تنتج طاقة كبيرة من انشطار اليورانيوم لأن كتلته أكبر بكثير من كتلة نواتج الانشطار.
- تفاعل الاندماج: هو تفاعل يحدث فيه اتحاد نواتين خفيفتين وقليلتي الاستقرار للحصول على نواة أثقل وأكثر استقرارا.
- لا يمكن الاعتماد على طاقتي ربط نواتين لمقارنة استقرارهما بل يجب المقارنة بين طاقتي الربط لكل نوية `A//E_L` لنواتين
- منحن أستون يمثل علاقة بيانية بين القيمة السالبة لطاقة ربط كل نوية (`A//E_L`) والعدد الكتلي `A`
- الفائدة منه: - تحديد المجال حسب قيم العدد الكتلي `A `لأنوية:
- التي يمكن أن يحدث لها اندماج نووي: `A<20`
- التي يمكن أن يحدث لها انشطار نووي: `A>190`
- الأنوية المستقرة: `20 le A le 190`
الوحدة الثالثة: دراسة الظواهر الكهربائية
- المكثفة: هي ثنائي قطب يتكون من صفيحتين متماثلتين ناقلتين يفصل بينهما عازل. - الفائدة العملية: تخزين الطاقة الكهربائية قصد استرجاعها وقت الحاجة.
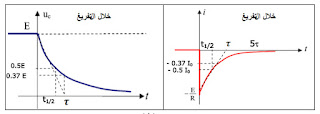
- نقول إن المكثفة قد شحنت تماما عندما يصبح التوتر بين طرفيها يساوي التوتر بين طرفي المولد أي: `U_C = E` عمليا إذا كان `U_C=0.99E` مدة شحن المكثفة هي `5\tau`
- شحنة المكثفة هي شحنة أحد لبوسيها.
- سعة المكثفة هي C: هو مقدار ثابت يتعلق بطبيعة العازل وبالخصائص الهندسية للمكثفة) مساحة سطح اللبوسين S والبعد بينهما L) ولا تتغير عند ربطها بدارة أخرى.
- للحصول على مكثفة سعتها أكبر من أكبر السعات نربط المكثفات على التفرع.
- في حالة الشحن: يتزايد التوتر تدريجيا) نظام انتقالي (إلى قيمة ثابتة غير معدومة) نظام دائم.
- عالقة شدة التيار بالشحنة `I=q/t` إذا كان التيار ثابت. `i=(dq)/dt` إذا كان التيار متغير الشدة
- إذا كانت شدة التيار ثابتة والجهد بين طرفي المكثفة ممثل البيان `U_c=f(t)`، يكون : `U_c=E` في حالة الشحن: `U_c=q/c=(i\times t)/c` ومنه : `C= (i\times 5 tau)/U_c`
- الثابت `tau` هو الزمن اللازم لبلوغ التواتر بين طرفي المكثفة القيمة: `0.63E` في حالة الشحن والقيمة `0.37E` عند التفريغ.
- الوشيعة: هي ثنائي قطب يتكون من لفات دائرية لسلك معدني ناقل. - مميزاتها: المقاومة الداخلية `r` والذاتية `L` الذاتية `L`: مقدار موجب تتعلق قيمته بالشكل الهندسي للوشيعة (طولها `l` ، نصف قطر لفاتها `R` ، عدد لفاتها `N` ) كما أن وجود النواة الحديدية يؤثر على ذاتيتها.
- في دارة تحتوي على مقاومة ووشيعة عند غلق القاطعة يزداد التيار الكهربية على شكل دالة أسية: `i(t)=I_0(1-e^(-t/tau))` ، الجهد بين طرفي المقاومة: `U_R(t)=I_0R(1-e^(-t/tau))` ;وبين طرفي الوشيعة: `U_L(t)=rI_0+RI_0e^(-t/tau)`
- : الوشيعة في النظام الدائم تتصرف تصرف الناقل الأومي.
- ثابت الزمن `tau` في ثنائي القطب `RL` : هو الزمن اللازم لبلوغ التيار المار في الوشيعة بعد غلق القاطعة القيمة `i=0.63I_0`
- يتم حساب الطاقة المحولة في الناقل الأومي أثناء تفريغ المكثفة بالفرق بين الطاقة العظمى المخزنة أثناء عملية الشحن والطاقة المتبقية في المكثفة وتحسب الطاقة المتبقية بتطبيق العلاقة: `E_C=1/2 C U_C^2`
- المكثفة تخزن الطاقة على شكل طاقة كهربائية الكترونية أما الوشيعة فهي تخزنها على شكل طاقة كهربائية مغناطيسية ويمكن شحن مكثفة وتفريغها في دارة أخرى أما الوشيعة فلا يمكن الاستفادة من الطاقة المخزنة فيها في دارة أخرى.
- يمكن استعمال راسم الاهتزاز المهبطي لمشاهدة صور لتطور التيار المار في الوشيعة وذلك بمتابعة تطور التوتر بين طرفي الناقل الأومي `U_R(t)` لأنه حسب قانون أوم `U_R(t)=RI(t)` فالتيار `i(t)` يتطور بنفس تطور `U_R(t)`
- الشكل التالي يمثل `U_C=f(t)` و `I=g(t)` في حالة تفريغ المكثفة مع تحديد قيمة `tau` وقيمة `t_(1/2)`
الوحدة الرابعة: تطور حالة جملة كيميائية نحو حالة التوازن
- الحمض: هو كل مركب كيميائي قادر على فقدان بروتون هيدروجيني) H + (أو أكثر).
- الأساس: هو كل مركب كيميائي قادر على اكتساب بروتون هيدروجيني) H + (أو أكثر).
- انحلال الحمض في الماء هو نفاعل محض _ أساس لأنه يحدث فيه انتقال للبروتونات من الحمض `AH` إلى الأساس `H_2O` وتشارك فيه ثنائيتان: `AH//A^-` ، `H_3O^+//H_2O` وتكتب معادلة التفاعل من الشكل الآتي: `AH_(aq)+H_2O_(l)= A_(aq)^- + H_3O_(aq)^+`
- وتعطى `pH` المحاليل المائية بالعبارة: `pH=-log[H_3O^+]` وذلك من أجل: `[H_3O^+] le 5 \times 10^-2 "mol/l"`
- نعرف الجداء الشاردي للماء Ke في المحاليل المائية كما يلي: `K_e=[H_3O^+] \times [OH^-]` عند `25°C` : `K_e=10^-14`
- يسمى كسر التفاعل عند التوازن: ثابت التوازن K ، لا تتعلق قيمة K بالشروط الابتدائية لكنه يتعلق بدرجة الحرارة:
- نسبة التقدم النهائي لتفاعل هي النسبة بين التقدم النهائي والتقدم الأعظمي ورمزها : `tau_f` حيث `tau_f=X_f/(X_(max))`
- فإذا كانت `tau_f=1` التفاعل تام، `tau_f<1` التفاعل غير تام.
- إذا كان: `PKa_1(A_1 "/" B_1) lt PKa_2(A_2 "/"B_2)` فإن: الحمض: `A_1` أقوى من الحمض `A_2` والأساس: `B_2` أقوى من الأساس `B_1`

ليست هناك تعليقات:
إرسال تعليق